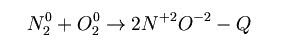Семинар "Азот и живот"
Презентацията на тема: "Азот и неговите съединения"
Без азот не е възможно съществуването на живата природа.Той е биогенен елемент, заедно с кислорода, водорода и въглерода.
С най-голямо приложение, от неговите съединения, са амонякът, азотната киселина, амониевите соли и някои от азотните оксиди.
Тук ще ви запознаем с някои по-интересни свойства и приложения на азота и неговите съединения.

Строеж на атомите на азота
Просто вещество
- Азотът (на латински: Nitrogenium) е химичен елемент. Означава се с буквата N. Намира се в 5А група, във втори период. Той има пореден номер Z = 7. Названието 'азот' идва от гръцки и означава „безжизнен“
- В ядрото си азотът има седем протона. Седемте електрона в електронната му обвивка са разположени в два електронни слоя. Молекулите на азота са двуатомни и неполярни. Между тях действат много слаби сили на привличане. В молекулата на азота атомите са свързани с много здрава тройна ковалентна химична връзка. Свободните атоми азот имат голяма химична активност. Около 79% от атмосферния въздух е азот.

Любопитни факти за азота


- Учени успели да запазят в среда от течен азот при температура -197C извадени зъби. След това при размразяване зъбите могат да се присадят и да продължат да изпълняват функциите си.
- При температура -197 C в среда от течен азот металите придобива 3,5 пъти по-голяма специфична електропроводимост от медта.
- Яйцеклетка на пациентка е престояла една година в течен азот при минус 196 градуса, след това е била размразена и оплодена. Досега в България са замразявани успешно само сперматозоиди и ембриони.
... И още факти...
- В атмосферата азотът се намира в свободна форма във вид на молекула N2. Растенията могат да усвояват азота само в свързан вид (като атоми). Бактериите от рода Rhizobium играят тази важна роля в селското стопанство. Те образуват азото-фиксиращи възелчета в корените на бобовите като грах, фасул, люцерна. Фиксацията на азота облегчава изискванията за допълнително азотно наторяване.
- Един от основните екологични проблеми е наличието на азот в отпадъчните води - предизвиква пренаторяване на водните басейни. От друга страна азота под формата на амониеви йони, допълнително се окислява до нитрат и предизвиква недостиг на кислород. Най-важното ниво за редукция на азота е биологичното. С помоща на бактерии, азота се освобождава в околната среда под формата на газ. За да се постигне това са нужни два процеса - нитрификация и денитрификация.
- В спектрите на полярните сияния е открито също така излъчване на молекулите на азота. То придава синия и виолетовия цвят на някои части от сиянията.

Съединения на азота
Амоняк
- Амоняк- един атом азот се свързва с три атома водород. Амонякът е добре разстворим във вода - реакцията е известна като „фонтан”.
- Добавката на амоняк в цигарите е за да помогне при горенето да се отдели повече никотин, който по принцип изгаря при самото горене.
- Амоняка не само изкарва никотин от тютюна, но и помага да се усвои от белия дроб. Самият амоняк бързо се окислява в кръвта и създава опасност за поражение на кръвните клетки.
- Крем боя с интензивен блясък Съдрържание: амоняк и водороден пероксид, може да предизвика аергична реакция. Избягваите контакт с очите. По-добре не използвайте.
- Когато рибките се хранят, те преработват храната и след това … акат – отделят амоняк – силно отровно химично съединение, съдържащо азот. Амоняк се отделя и при гниенето на изпражненията на рибките и на старите, мъртви листа на растенията.
- Има обаче едни хубави и полезни бактерии, които живеят залепени по всякакви повърхности в аквариума – по стъклото, по листат и най-вече в пълнежа на филтъра. Тези бактерии ядат амоняк и произвеждат нитрити – съединения на азота, които обаче не са толкова отровни колкото него.
- Така те спасяват вашите риби от отравяне.
Оксиди на азота
Съединения на азота с кислород
- Диазотният оксид, още известен като "райски газ", е химично съединение с емпирична формула N2O. Той е неутрален оксид. При стайна температура е безцветен незапалим газ, с приятна сладникава миризма и вкус. Използва се в хирургията и денталната медицина (зъболечението) заради своя анестетичен и аналгетичен ефект. Името му "райски газ" идва от чувството за еуфория, което причинява при вдишване. Това свойство на газа му дава приложение и като наркотик. Друго негово приложение е като окислител в ракетните двигатели. Използва се и при двигателите с вътрешно горене - добавен към горивото, увеличава мощността им.
- Азотният оксид (NO) е безцветен газ, неразтворим във вода. Не взаимодейства с киселини и основи. Той е неутрален оксид. Получава се при пряко взаимодействие на азот с кислород. Степента на окисление на азота в този оксид е + 2. Получаване(с помощта на електрическа искра):
- Диазотният триоксид (N2O3) е анхидрид на азотистата киселина. Той е газ и е синьо-зелен на цвят. Степента му на окисление е + 3. Той е силно токсичен нетраен газ.
- Азотният диоксид (NO2) е жълто-кафяв, силно отровен, лесно втечняем газ. Той дразни лигавицата на очите и дихателните органи, предизвиква хрипове, кашлица, задух. Концентрация от 0,4 mg/dm3 е смъртоносна за възрастен човек. Азотният диоксид е киселинен оксид. Взаимодейства с оксиди и основни оксиди. Той е и силен окислител. Степента му на окисление е + 4. Получаване:
- Азотният диоксид е разтворим и взаимодейства химически с вода, при което се получават азотна киселина и азотиста киселина:
- Диазотният пентаоксид (N2O5) е анхидрид на азотната киселина; кристално, безцветно вещество. Той е нетраен и при обикновени условия се разлага на азотен диоксид и кислород. С водата образува азотна киселина. Много силен окислител със степен на окисление + 5:

- Високото съдържание на азотни оксиди в атмосферата предизвиква сериозни екологични проблеми - киселинни дъждове и смог. Основни замърсители на околната среда с азотни оксиди са тецовете, азотноторовите заводи, моторните превозни средства
- Хемилуминисцентният детектор за азот Agilent 255 NCD е специфичен детектор, който продуцира сигнал за съединения, съдържащи азот. Това се извършва чрез използването на горелка за постигането на високотемпературно разлагане на съдържащите азот съединения и последващо образуване на азотен оксид (NO). Светлината, излъчена при хемилуминисцентната реакция на NO с озон, се детектира